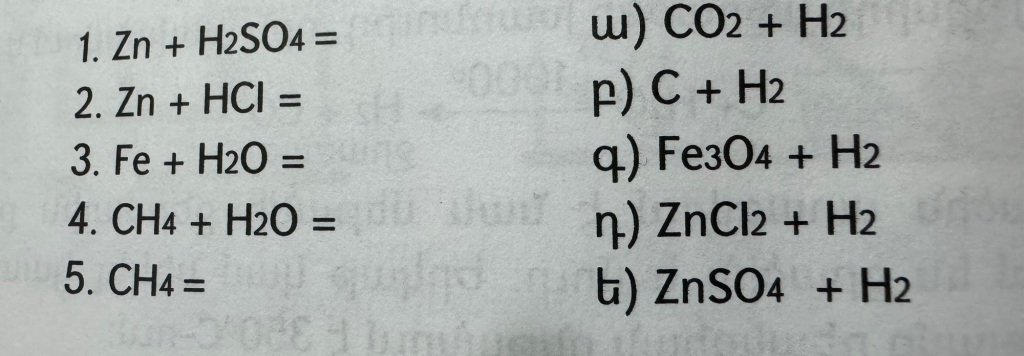Նոր թեմա՝ Ջրի քիմիական հատկությունները
Էջ՝ 166-167
Նոր թեմա՝ Ջուրը՝ որպես լուծիչ։ Լուծույթներ։
Էջ՝ 168-171
Ջուրը կայուն նյութ է, մինչև 1000°Cտաքացնելիս այն փոփոխության չի ենթարկվում։ Ավելի բարձր ջերմաստիճաններում, ինչպես նաև ուլտրամանուշակագույն և ռենտգենյան ճառագայթների ազդեցության տակ այն քայքայվում է՝ առաջացնելով ջրածին և թթվածին:
Նույն արգասիքներն առաջանում են ջուրն էլեկտրական հոսանքով քայքայելիս՝

Ջուրը կարող է մասնակցել տարբեր քիմիական ռեակցիաների` միացման, քայքայման, տեղակալման, փոխանակման։ Ջուրը փոխազդում է բազմաթիվ պարզ և բարդ նյութերի հետ։
Ջրի փոխազդեցությունը մետաղների հետ
Սենյակային ջերմաստիճանում ջուրը փոխազդում է ալկալիական և հողալկալիական մետաղների հետ:

Լուծույթները և դրանց կոնցենտրացիաները
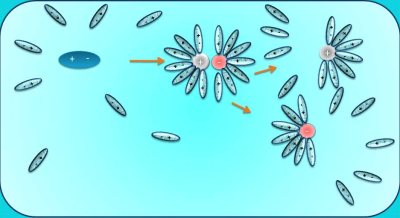
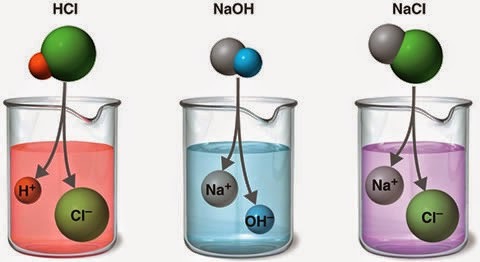
Լուծույթն այն համասեռ համակարգն է, որը բաղկացած է լուծիչից, լուծված նյութից և դրանց փոխազդեցության արգասիքներից:
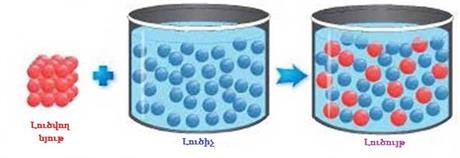
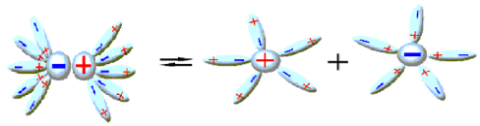
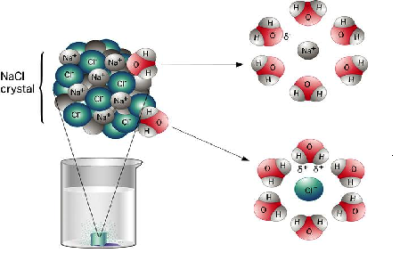
Ջուրը համընդհանուր լուծիչ է:

Ըստ ջրում լուծվելու հատկության նյութերը լինում են՝ լավ լուծվող, քիչ լուծվող և գործնականում չլուծվող:
- Եթե լուծույթը պարունակում է առավելագույն քանակով լուծված նյութ, ապա կոչվում է հագեցած:
- Եթե լուծույթը պարունակում է ավելի քիչ լուծված նյութ, քան համապատասխանում է հագեցած լուծույթին, ապա կոչվում է չհագեցած:
- Եթե լուծույթը պարունակում է ավելի շատ լուծված նյութ, քան համապատասխանում է հագեցած լուծույթին, ապա կոչվում է գերհագեցած:
Լուծելիությունը նյութի առավելագույն զանգվածն է (գ), որը կարող է լուծվել 100 գ ջրում՝ տվյալ ջերմաստիճանի պայմաններում.
Լ=m(լ.ն.)։ m(ջուր)⋅100
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
- Ինչպե՞ս են փոխվում նյութերի խտությունները գազ հեղուկ → պինդ վիճակների անցնելիս.
ա) ցանկացած նյութի դեպքում
Ընդհանրապես, երբ նյութը գազից վերածվում է հեղուկի, մոլեկուլները կամ ատոմները մոտենում են միմյանց՝ նվազեցնելով ծավալը, ինչի արդյունքում խտությունը մեծանում է։
բ) ջուր նյութի դեպքում
Որպես կանոն, նյութերը փոքրանում են, երբ սառչում են, բայց ջուրն ընդարձակվում է, ինչը պայմանավորված է սառույցի ջրի մոլեկուլների կառուցվածքով:
- Սառույցը հեղուկ ջրի փոխարկվելիս ինչպե՞ս է փոխվում ծավալը.
ա) մնում է անփոփոխ
բ) փոքրանում է աննշան չափով
գ) մեծանում է
դ) փոքրանում է զգալի չափով
- Ինչո՞ւ է ջրով լիքը ապակյա փակ շիշը ջարդվում սառցախցիկում պահելիս:
Սառցախցիկում, որտեղ ջերմաստիճանը շատ ցածր է ջրի սառեցման կետից, շշի ներսում ջուրը կարող է սառչել: Այնուամենայնիվ, սառեցման հետ կապված ծավալի ավելացումը կարող է բավականաչափ մեծ ճնշում ստեղծել, որպեսզի ապակե շիշը կոտրվի: - Ինչո՞ւ ամռանը ջրի ջերմաստիճանն էական փոփոխության չի թարկվում:
Ամռանը ջրի ջերմաստիճանը էապես չի փոխվում ջրի բարձր ջերմունակության պատճառով և քանի որ ջուրը վատ ջերմահաղորդիչ է։ - Որքա՞ն են՝ ա) 18 գ բ) 36 գ) 54 գ զանգվածներով ջրի
Բանաձևը՝ զանգված=ծավալ*խտություն, 4°C ջերմաստիճանի ջրի համար խտությունը մոտ 1գ/մլ է
ա) նյութաքանակները
բ) ծավալները 4°C-ում
ա) 18 մլ
բ) 36 մլ
գ) 54 մլ
- Որքա՞ն է մոլեկուլների թիվը 2 լ ջրում (p= 1գ/մլ։
m=S×v=2000
2000/18 × 6,022 × 1023 = 6,69 × 1023մոլեկուլ
- Ի՞նչ ծավալով (լ,ն.պ.) ջրածին կանջատվի 90 գ ջրի և 80 գ կալցիումի փոխազդեցությունից:
2H2O+Ca=Ca(OH)2+H2
n(H2O)=m/M=90գ/18=5մոլ
n(Ca)=80գ/40=2մոլ
2մոլ/1մոլ
xլ/22,4լ
x=2×22,4=44,8լ(H2) - Մագնեզիումի և սիլիցիումի խառնուրդն առանց օդի մուտքի շիկաց– նելիս ստացվում է աղանման նյութ, որը ջրով քայքայվում է՝ առաջացնելով սիլան’ SiH4, գազը: Ի՞նչ քանակով (մոլ) մագնեզիում կպահանջվի 33,6 լ (ն.պ.) սիլան ստանալու համար:
?